Perbedaan antara mereka ada hubungannya dengan seberapa sama atom yang berpartisipasi dalam ikatan berbagi elektron. Karena berbagi elektron mereka menunjukkan sifat fisik karakteristik yang meliputi.

Trik Super Kilat Membedakan Senyawa Ion Dan Senyawa Kovalen Youtube
Secara umum elemen logam cenderung membentuk ikatan ionik dan elemen non-logam cenderung.

. Titik didih dan titik leleh yang tinggi. Oleh karena itu pola ikatan mereka dapat. Perbedaan sifat fisik senyawa ion kovalen dan logam.
Adanya nama dan sistem pnemaan senyawa kimia akan sangat memuhdakna dalam mengenali dan mempelajari bahanunsursenyawa kimia tersebut. Senyawa ionik adalah senyawa yang atom-atomnya berikatan secara ionik. Definisi dasar dari suatu senyawa ionik adalah bahwa mereka adalah molekul yang terdiri dari ion bermuatan.
Ikatan ion terjadi antara dua spesies yang secara elektrostatik tertarik satu sama lain sedangkan atom kovalen berikatan kovalen melalui pembagian elektron antara kulit terluarnya. Senyawa kovalen memiliki ikatan kovalen. Pada senyawa CH₄.
Senyawa kovalen dipisahkan jauh lebih mudah karena mereka terbentuk dari molekul-molekul yang berbeda. Perbedaan keelektronegatifan yang semakin besar akan menambah karakter ion dan mengurangi karakter kovalen. Bertambahnya muatan dan semakin kecilnya ukuran kation akan berakibat pada saya polarisasi.
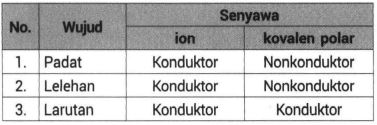
Di dalam air molekul HCl tersebut dapat terurai karena pengaruh air yang juga bersifat polar sehingga membentuk ion-ion H dan Cl -. Dalam ilmu kimia senyawa asam terdiri dari tiga definisi yaitu Arrhenius Bronsted-Lowry dan Lewis. Padatan wujud ini tidak dapat menghantarkan listrik karena dalam bentuk padatan tidak ada ion yang bergerak secara bebas.
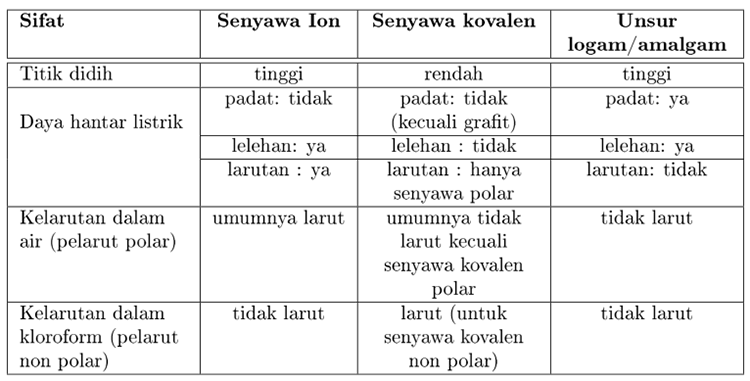
Titik didih dan titik leleh senyawa logam lebih tinggi dari senyawa ion senyawa ion lebih tinggi dari senyawa kovalen. Ini adalah perbedaan utama antara Senyawa Ionic dan Covalent. Secara umum unsur-unsur logam cenderung membentuk senyawa ionik dan unsur-unsur non-logam berakhir.
Senyawa molekuler lebih mudah terbakar dibandingkan senyawa ion. Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih. Wujud senyawa ion pada suhu ruang biasanya adalah padat senyawa kovalen ada yang gas ada yang cair sedangkan logam biasanya padat.
Berikut ini ringkasan singkat perbedaan antara ikatan ion dan kovalen sifat-sifatnya dan cara mengenalinya. Senyawa ion memiliki ikatan ion dalam bentuk lelehan dan larutan dapat terionisasi sempurna menghasilkan ion-ion yang dapat bergerak bebas. Pada zat yang dibandingkan sama-sama memiliki anion Cl.
Perbedaan antara ikatan ion dan kovalen. Ingat hidrogen dapat bertindak dengan cara apa pun Dua non logam. Perbedaan utama antara ikatan kovalen dan ion adalah ikatan ion terjadi antara dua spesies yang secara elektrostatik saling tertarik satu sama lain sedangkan ikatan kovalen terjadi secara kovalen melalui pembagian elektron di antara kulit terluarnya.
Sampai saat ini dikenal dua sistem penamaan senyawa termasuk senyawa biner. Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya. Tidak mudah patah dan mudah dibentuk.
Nahh demikian perbedaan sifat fisik dari Senyawa Ion Senyawa Kovalen dan Logam ya otakers Semoga bermanfaat yah. Senyawa kimia Kovalen dan Ion itu merupakan senyawa yang terbentuk melalui reaksi kimia dimana logam dan non logam mempunyai ikatan kimia dalam bentuk unsur. Senyawa molekuler yang lebih lembut dan lebih fleksibel.
Senyawa ionikSenyawa ionik adalah senyawa kimia kation dan anion yang diikat oleh ikatan ionik dalam struktur kisi. Ikatan ionik adalah ikatan yang dihasilkan dari perpindahan elektron dari satu atom ke atom lain. Entalpi fusi energi panas yang diserap bila padat mencair dan entalpi penguapan energi panas yang diserap ketika cairan mendidih lebih tinggi dalam senyawa ion.
Oleh karena itu karakter kovalen juga semakin bertambah. Contoh senyawa kovalen adalah Metana CH 4 Karbon monoksida CO Iodine monobromide IBr Ikatan kovalen. Dan memisahkan gaya tarik muatan positif dan negatif.
Juga senyawa kovalen dapat larut dalam air tetapi tidak berdisosiasi menjadi ion. Oleh sebab itu larutan yang bersumber dari senyawa ionik dapat menghantarkan arus listrik dengan baik dan termasuk ke dalam larutan elektrolit kuat. Lantas apa perbedaan senyawa dengan campuran dan unsur.
Perbedaan antara senyawa ionik dan kovalen dapat membingungkan. Pada hasil pengamatan terhadap pengujian senyawa ion dan kovalen dengan memanaskan senyawa-senyawa tersebut didapatkan perbedaan titik leleh antara dua senyawa tersebut. Senyawa kovalen memiliki ikatan di mana elektron dibagi antara atom.
Senyawa ion yang terbentuk dari interaksi elektrostatik yang kuat antara ion yang menghasilkan titik leleh yang lebih tinggi dan konduktivitas listrik dibandingkan dengan senyawa kovalen. Apa sih perbedaan senyawa Ionik dan senyawa Kovalen dalam terbentuknya rumus kimia non logam dan logam itu. HCl merupakan senyawa kovalen polar yang berarti mempunyai kutub-kutub positif dan negatif akibat adanya perbedaan keelektronegatifan.
Apa yang membedakan Ikatan ion dan kovalen. Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik. Lelehan wujud ini dapat menghantarkan listrik karena dalam bentuk lelehan ion-ionnya bergerak relatif bebas.
Perbedaan antara senyawa ionik dan senyawa molekul. Mengenai penjelasan sebagai berikut. Apa perbedaan antara Senyawa Ionik dan Kovalen.
Urea mempunyai titik leleh pada kisaran antara 30 95 naftalena antara 30 -61 NaCl antara 85 100 KI antara 62 100 MgSO4 antara 30. Dua jenis ikatan adalah ikatan ion dan ikatan kovalen. Pengertian Senyawa Ionik dan Senyawa Kovalen.
Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Meskipun senyawa dan unsur adalah zat tunggal. Satu atom memberikan satu atau lebih dari elektron.
Jenis ikatan yang ada pada senyawa CH₄ adalah ikatan kovalen karena atom hidrogen dan karbon menggunakan bersama sepasang elektron pilihan C12 Jun 2019. Jenis ikatan kimia antara lain ikatan ion dan kovalen. Terdapat 4 ikatan kovalen tunggal.
Molekul yang bisa memberikan ion Hidrogen H dan membentuk ikatan kovalen dengan asam lewis. Sobat hitung kali ini kami akan berbagi materi tentang Tata Nama senyawa biner baik yang biner ionik maupun biner kovalen. Suatu molekul atau senyawa dibuat ketika dua atau lebih atom membentuk ikatan kimia yang menghubungkannya bersama.
Ion-ion dalam larutan HCl inilah yang berperan sebagai penghantar listrik. Dapat menghantarkan listrik dan panas. Perbedaan Kunci - Senyawa Ionic vs Kovalen.
Jenis ikatan apa yang terdapat pada senyawa ch4.
![]()
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube

C Tatanama Senyawa Kovalen Endah21zuraidah

Sebutkan Sifat Atau Ciri Senyawa Kovalen Dan Ion Brainly Co Id

Sebutkan 5 Contoh Perbedaan Antara Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Buat Yang Kelas 10 Yuk Mengenal Ikatan Ikatan Kimia Dalam Atom

Contoh Senyawa Ion Beserta Namanya

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Tata Nama Senyawa Dan Pembahasan Secara Lengkap

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id

Perbedaan Senyawa Ion Senyawa Kovalen Dan Logam Utakatikotak Com

Pengertian Senyawa Kovalen Polar Dan Nonpolar Serta Perbedaannya

Perbedaan Senyawa Ionik Dan Kovalen Penjelasan Materi Lengkap Hisham Id
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College


